Aspergillus fumigatus ist ein weit verbreiteter filamentöser Schimmelpilz, dessen Sporen ubiquitär in der Luft vorkommen und täglich über die Atmung aufgenommen werden. Während das Immunsystem gesunder Menschen in der Lage ist diese abzutöten, keimen sie bei immunsupprimierten Personen häufig in der Lunge aus. Die Hyphen und das Myzel des Pilzes verbreiten sich schließlich im ganzen Körper. Dieses als invasive Aspergillose bezeichnete Krankheitsbild führt bei bis zu 90 % der Patienten zum Tode.
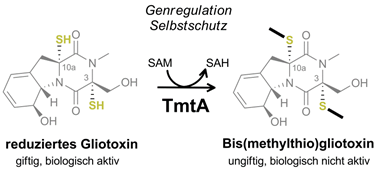
Einer der Virulenzfaktoren von A. fumigatus ist der immunsuppressiv und zytotoxisch wirkende Sekundärmetabolit Gliotoxin. Als Vertreter der Epidithiodioxopiperazin (ETP)-Verbindungen und besitzt er eine reaktive Disulfidbrücke, die essentiell für seine Bioaktivität ist. Die entsprechenden Schwefelatome stammen dabei aus zwei Glutathion-Molekülen, die im Laufe der Gliotoxinbiosynthese mit dem Diketopiperazin-Grundgerüst verknüpft werden. Sequentieller Abbau der Glutathionreste führt zur Freilegung der Thiolgruppen, die schlussendlich enzymatisch zur Disulfidbrücke oxidiert werden.
Der Mechanismus der Bildung der Kohlenstoff-Schwefel-Bindungen durch die Glutathion-Transferase GliG ist bisher nicht vollständig verstanden. Voraussetzung für den nukleophilen Angriff der Glutathion-Moleküle auf das Diketopiperazin scheint jedoch eine Aktivierung durch die Monooxygenase GliC zu sein. Gemäß bioinformatischer und phylogenetischer Analysen bildet GliG den Prototypen einer neuen Klade von Glutathion-Transferasen, Vertreter derer in allen ETP Biosyntheseclustern vorhanden sind. Im Rahmen des von der Hans-Fischer-Gesellschaft geförderten Projektes wird deshalb die strukturelle und biochemische Charakterisierung von GliG anvisiert.