Aspergillus fumigatus ist ein weit verbreiteter filamentöser Schimmelpilz, dessen Sporen ubiquitär in der Luft vorkommen und täglich über die Atmung aufgenommen werden. Während das Immunsystem gesunder Menschen in der Lage ist diese abzutöten, keimen sie bei immunsupprimierte Personen häufig in der Lunge aus. Die Hyphen und das Myzel des Pilzes verbreiten sich schließlich im ganzen Körper. Dieses als invasive Aspergillose bezeichnetes Krankheitsbild führt bei bis zu 90 % der Patienten zum Tode.
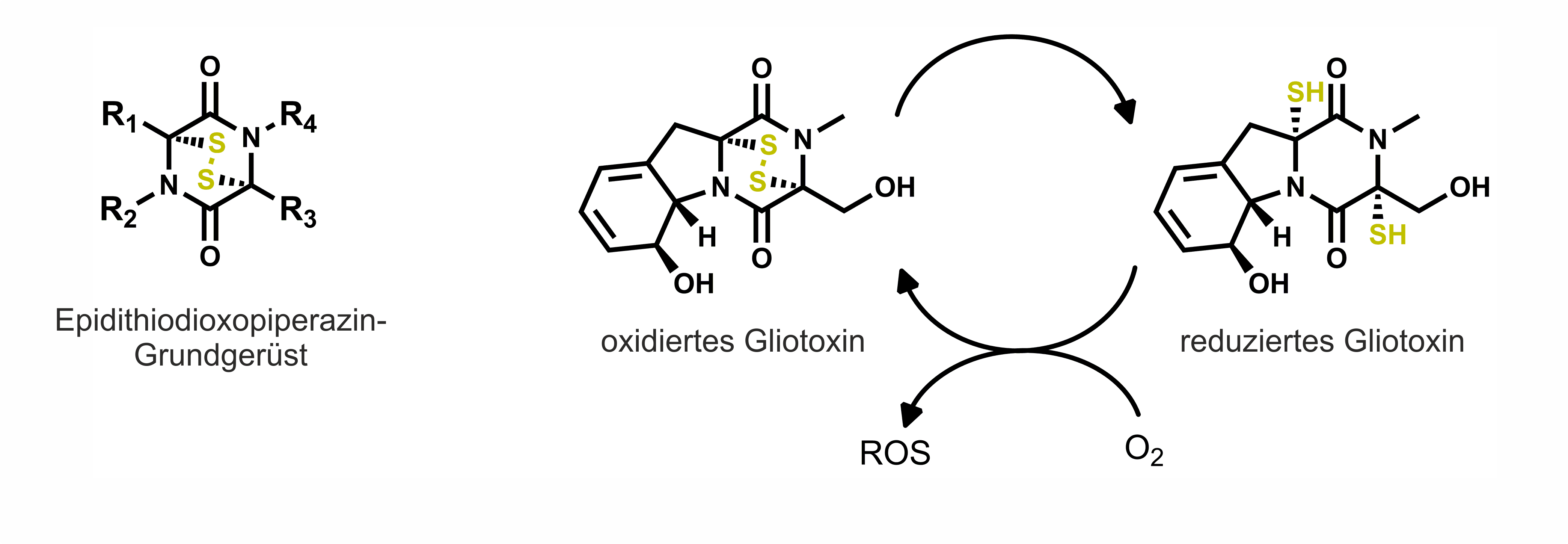
Einer der Virulenzfaktoren von A. fumigatus ist der immunsuppressiv und zytotoxisch wirkende Sekundärmetabolit Gliotoxin. Gliotoxin zählt zu den Epidithiodioxopiperazin-Verbindungen und besitzt eine reaktive transannulare Disulfidbrücke, die essentiell für seine Bioaktivität ist. In der Zelle wird die Disulfidbrücke durch das reduzierende Milieu gespalten, kann jedoch auch wieder reoxidiert werden, wobei reaktive Sauerstoffspezies entstehen und das Redoxgleichgewicht der Zelle gestört wird (siehe Abbildung). Zudem kann Gliotoxin durch die Bildung gemischter Disulfide mit anderen schwefelhaltigen Enzymen diese inaktivieren.
Die an der Biosynthese von Gliotoxin beteiligten Enzyme sind in einem Gencluster codiert und einige von ihnen konnten in den letzten Jahren bereits biochemisch analysiert werden. Um jedoch Hemmstoffe für die Gliotoxinbiosynthese entwickeln zu können und Infektionen mit A. fumigatus gezielt bekämpfen zu können, sind strukturelle Informationen über die involvierten Enzyme notwendig.
Im Rahmen des von der Hans-Fischer-Gesellschaft geförderten Projektes wird ein interessanter Teilaspekt der Gliotoxinbiosynthese untersucht: die Dipeptidase GliJ. Die Primärsequenz von GliJ weist eine hohe Ähnlichkeit zu einer Zink-abhängigen humanen Dipeptidase aus der Niere auf. Um die Funktionsweise von GliJ im Unterschied zum humanen Pendent besser verstehen und analysieren zu können, wird eine Kristallstruktur von GliJ im Komplex mit einem Liganden anvisiert.